Дослідники натренували глибинні нейронні мережі (DNN) для виявлення особливостей COVID-19 на УЗД-зображеннях легенів. Механізм нагадує процес розпізнавання обличчя в натовпі, а всі бази даних вчені виклали у відкритому доступі.
Як працює нейромережа
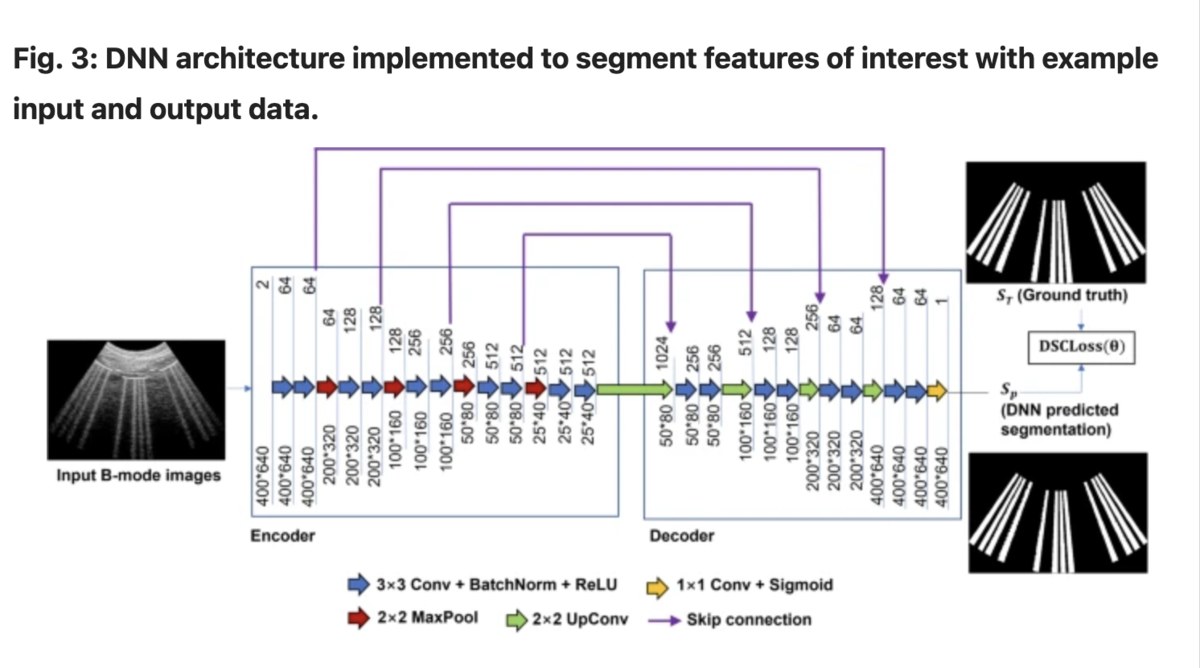
Вчені розробили та перевірили сім різних стратегій, щоб навчити нейромережу. База, яку брали для навчання, включала реальні дані та змодельовані дані пацієнта, щоб навчити обчислювальний інструмент правильно діагностувати особливості зображення з високою точністю. Змодельовані дані були створені за допомогою програмного забезпечення, яке моделює фізику ультразвуку та поширення акустичних хвиль.

«На початку пандемії у нас не було достатньо ультразвукових зображень пацієнтів з COVID-19, щоб розробити та перевірити наші алгоритми, і в результаті наші глибокі нейронні мережі так і не досягли максимальної продуктивності», — сказав перший автор Лінгі Чжао, який розробив програмне забезпечення. під час докторантури в лабораторії Белла, а зараз працює в Novateur Research Solutions, як пише Medical Xpress.
Перший набір даних — це загальнодоступний набір даних, що включає 202 відео та 59 зображень зразків пацієнтів із COVID-19, пацієнтів із бактеріальною пневмонією, (не COVID-19) вірусною пневмонією та здорових осіб контрольної групи.
Для другого набору даних для досліджень вчені використали зображення, отримані за допомогою конвексного зонда (Clarius C3HD) і програми Clarius Ultrasound (v8.0.1, Clarius Mobile Health Corp.) в американські лікарні Джонса Хопкінса (Балтимор, штат Мериленд, США) з грудня 2021 року по травень 2022 року.

Дані розділили випадковим чином на кілька частин, щоб зробити трикратну перехресну перевірку.
«Ми розробили цей автоматизований інструмент виявлення, щоб допомогти лікарям у невідкладних ситуаціях із великою кількістю пацієнтів, які потребують швидкої та точної діагностики, як, наприклад, на ранніх стадіях пандемії», — сказав старший автор Муїнату Белл, асоційований співробітник Джон С. Малоун, професор електротехніки та комп’ютерної інженерії, біомедичної інженерії та комп’ютерних наук в Університеті Джона Гопкінса.
«Потенційно ми хочемо мати бездротові пристрої, якими пацієнти також могли б користуватися вдома для моніторингу прогресування COVID-19», — зазначив науковець.
Як проходили тестування
За допомогою MATLAB вчені змоделювали близько 30 000 фантомів легенів на основі загальнодоступних in vivo ультразвукових зображень. Для підвищення варіабельності змінено положення та ехогенність ознак. Щоб створити кожен фантом, розсіювачі були випадковим чином розподілені по УЗД-зображенню, включаючи шари шкіри, шари м’язів, плевральні лінії та ребра. Амплітуду кожного розсіювача вибирали випадковим чином із попередньо визначеного діапазону для кожної функції.
«Ідеальним варіантом використання були б переносні ультразвукові пластирі, які відстежують накопичення рідини та повідомляють пацієнтам, коли їм потрібна корекція ліків або коли їм потрібно звернутися до лікаря», — сказала співавтор Тіффані Фонг, доцент кафедри невідкладної медицини Джона Хопкінса.
Щоб визначити найбільш підходящу стратегію для пацієнтів з COVID-19 вчені:
- Навчили мережі сегментувати функції лінії B за допомогою кількох комбінацій стратегій навчання та тестування.
- Перевірили продуктивність мережі за допомогою ультразвукових зображень легенів у B-режимі пацієнтів з COVID-19.
- Порівняли тестові DSC кожної мережі та визначаємо найбільш прийнятний підхід щодо точності прогнозування та кількості необхідних епох навчання.
Цей підхід має наслідки для виявлення COVID-19 і моніторингу пацієнтів із тривалим COVID-синдромом і пост-COVID-синдромом.
Що в підсумку
Дослідники визнали тестування генеративної моделі успішним, використовуючи різні комбінації доступних навчальних наборів даних та надали публічний доступ до змодельованих наборів даних:
- Набір парних наземних сегментацій істинності та міток сегментації для набору даних in vivo POCUS за посиланням.
- Набір даних POCUS доступний за посиланням.
- Змодельований і позначений набір даних in vivo COVID-19 за посиланням.



